Новое решение совета Евразийской экономической комиссии № 67 вышло в сентябре 2020 года, в нем были описаны дополнения к правилам проведения исследований биоэквивалентности лекарственных препаратов для местного применения. В данной статье рассмотрим Приложение 9 биоэквивалентность кортикостероидных лекарственных препаратов для местного применения.
Кортикостероиды — общее собирательное название подкласса стероидных гормонов, производимых исключительно корой надпочечников, обладают выраженным противовоспалительным, противоаллергическим, антиэкссудативным и противозудным действиями при местном нанесении.
Регистрация воспроизведенных (дженериков) кортикостероидных лекарственных препаратов для местного применения должна основываться в первую очередь на оценке фармакодинамических эффектов. Под фармакодинамикой понимают то, как препарат действует на организм — это изучение биохимических, физиологических и молекулярных эффектов лекарственных средств на организм человека. Такой подход обусловлен свойством кортикостероидов вызывать побледнение кожи вследствие сужения сосудов, что связано с количеством действующего вещества, поступившего в кожу. Именно это свойство является основанием для сравнения действующего вещества из двух потенциально эквивалентных составов кортикостероидных лекарственных препаратов для местного применения.
Общий метод анализа сужения сосудов основан на местном нанесении здоровым добровольцам кортикостероидного лекарственного препарата на период 6 – 16 часов, с последующей визуальной оценкой наблюдателем степени побледнения кожи, в одной временной точке и через 2 часа после удаления препарата.
Давайте разберем более подробно.
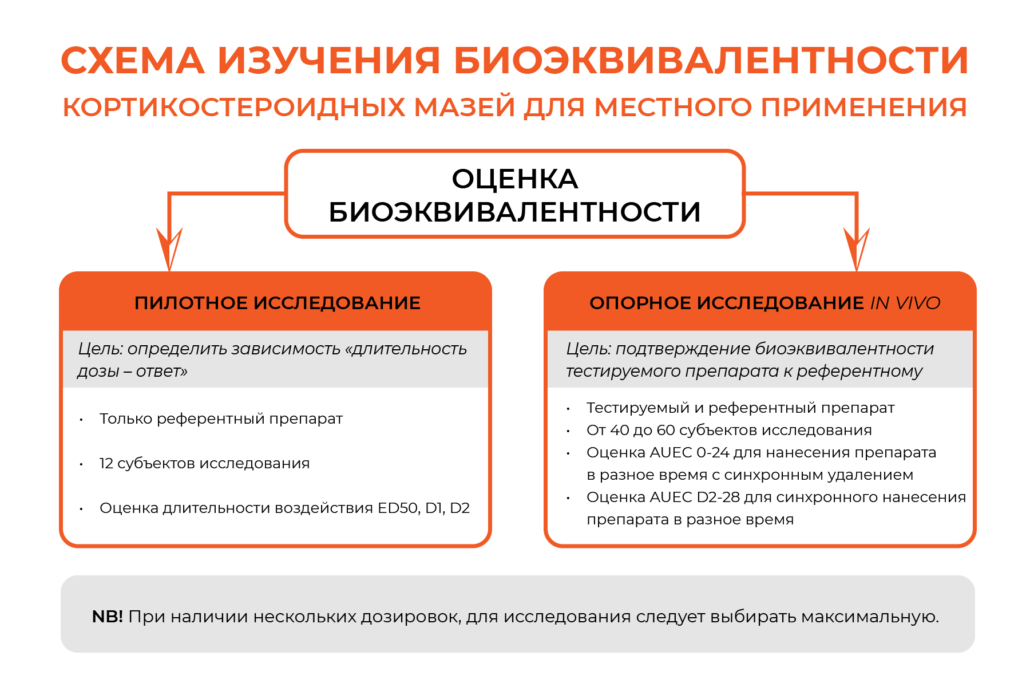
В настоящее время для сравнения исследуемого и референтного лекарственных препаратов предполагается проведение двух исследований in vivo — пилотного исследования зависимости «длительность воздействия дозы – ответ» и опорного клинического исследования биоэквивалентности in vivo.
Пилотное исследование проводится исключительно с использованием референтного препарата. Цель пилотного исследования определить взаимосвязь между дозой и продолжительностью реакции, которая будет изучаться далее в опорном клиническом исследовании. Исследование аналогично разработке стандартной кривой при анализе лекарственного средства в биологической жидкости. Участвует 12 субъектов исследования. Предпочтительный для подтверждения биоэквивалентности метод оценки длительности воздействия дозы основан на использовании трех длительностей воздействия доз: длительность воздействия дозы, при применении которой эффект составляет половину от максимального (ED50), длительность воздействия дозы, равная половине ED50 (D1) и длительность воздействия дозы, равная двойной ED50 (D2). Применение аппаратной хромаметрии или колориметрии позволяет заменить субъективную визуальную оценку в рамках анализа сужения сосудов на объективную, определяемую количественно, оценку.
Критерии включения в исследование:
- здоровый доброволец
- у субъекта наблюдается выраженное сужение сосудов в ответ на применение кортикостероидного лекарственного препарата для местного действия
- наличие подписанного информированного согласия субъекта
- желание и готовность соблюдать все условия проведения исследовании
Критерии исключения:
- Клинически значимая артериальная гипертензия или болезни кровообращения
- Курение в течение 1 недели до начала исследования и во время исследования
- Потребление кофеина более 500 мг в день до начала или во время исследования
- Клинически значимая алкогольная или наркотическая зависимость в анамнезе
- использование дерматологических лекарственных препаратов для местного применения, наносимых на переднюю поверхность предплечий (включая предшествующее нанесение кортикостероидного лекарственного препарата для местного применения на определенный участок кожи в ходе фармакодинамического исследования) в течение 1 месяца до начала исследования
- нежелательные реакции на кортикостероидные лекарственные препараты местного или системного действия
- Любое заболевание в анамнезе или в настоящее время (включая активный дерматит) или любое другое дерматологическое состояние, которые могут существенно повлиять на фармакодинамический ответ на вводимый лекарственный препарат
- Необходимость удаления с передних поверхностей предплечий субъекта волос, не позволяющих обеспечить нанесение соответствующей дозы лекарственного препарата на поверхность кожи
- Применение субъектом любых вазоактивных лекарственных препаратов, способных повлиять на кровоток (вазоконстрикторов или вазодилататоров), независимо от порядка отпуска этих лекарственных препаратов (по рецепту или без рецепта). Примерами таких лекарственных препаратов являются нитроглицерин, гипотензивные и антигистаминные лекарственные препараты, нестероидные противовоспалительные препараты (в том числе аспирин), сиропы от кашля или сиропы для симптоматического лечения острой респираторной вирусной инфекции, содержащие антигистаминные действующие вещества и (или) фенилпропаноламин, а также лекарственные препараты содержащие фентоламин
- Любое очевидное различие в цвете кожи рук субъекта.
Целью опорного исследования является документальное подтверждение биоэквивалентности тестируемого препарата по отношению к референтному.
Сравнение исследуемого и референтного кортикостероидных лекарственных препаратов в рамках опорного исследования проводится на уровне, длительности воздействия дозы, приблизительно эквивалентном популяционной ED50 по результатам пилотного исследования. Критерии включения и исключения субъектов исследования аналогичны. Участвуют от 40 до 60 человек.
Каждый субъект выступает в роли «детектора» в таком исследовании, поэтому только данные тех субъектов, у которых отношение фармакодинамических ответов на дозе D2 к дозе D1 соответствует установленному минимальному значению, могут быть включены в анализ и подвергнуты статистической обработке для подтверждения биоэквивалентности in vivo. Общее число исследуемых участков составляет 16 (по 8 участков на каждой руке). Схемы нанесения на каждой руке должны быть комплементарны, то есть D2 является комплементарным D1, участки нанесения референтного лекарственного препарата комплементарны участкам нанесения исследуемого лекарственного препарата, а также комплементарны контрольные участки.
Показатели степени сужения сосудов, измеренные хромаметром и скорректированные по исходному значению состояния сосудов на контрольных участках кожи без нанесения лекарственного препарата, должны подтвердить, что у субъектов исследования отсутствуют: разница в ответах кожи левой и правой рук на лекарственный препарат; влияние на величину ответа места нанесения лекарственного препарата на кожу руки, расположенного не ближе 3 – 4 см до локтевой ямки или до запястья.
Во время опорного исследования также следует рассчитать значения площади под фармакодинамической кривой AUEC для каждой длительности воздействия дозы на контрольных участках: AUEC (0-24) для нанесения препарата в разное время с последующим синхронным удалением; AUEC(D2-28) (от времени D2 до 28 часов) для синхронного нанесения препарата с последующим удалением через разные промежутки времени.
Команда X7 Сlinical Research сможет провести исследование биоэквивалентности кортикостероидных лекарственных препаратов для местного нанесения качественно и требуемые сроки. Мы будем рады ответить на любые вопросы!






 Полина Хлябова присоединилась к команде X7 Clinical Research в 2019 году в должности Директора по обеспечению качества. Занимается клиническими исследованиями с 2010 года. Имеет более 4-х лет опыта обеспечения системы управления качеством в исследовательских центрах и контрактно-исследовательских организациях. Участвовала более, чем в 34 исследованиях в качестве главного исследователя, и в 90 исследованиях в качестве со-исследователя. В 2008 году закончила лечебный факультет СПбГМА им. И.И. Мечникова, врач терапевт, клинический фармаколог, аллерголог иммунолог. C 2015 имеет диплом по «Организации здравоохранения и общественного здоровья».
Полина Хлябова присоединилась к команде X7 Clinical Research в 2019 году в должности Директора по обеспечению качества. Занимается клиническими исследованиями с 2010 года. Имеет более 4-х лет опыта обеспечения системы управления качеством в исследовательских центрах и контрактно-исследовательских организациях. Участвовала более, чем в 34 исследованиях в качестве главного исследователя, и в 90 исследованиях в качестве со-исследователя. В 2008 году закончила лечебный факультет СПбГМА им. И.И. Мечникова, врач терапевт, клинический фармаколог, аллерголог иммунолог. C 2015 имеет диплом по «Организации здравоохранения и общественного здоровья».
 Кристина Берестян присоединилась к команде X7 Clinical Research в 2019 году в должности Специалист по вводу данных, затем как Специалист по набору субъектов исследования. За время работы в X7 Clinical Research приняла участие в клинических исследованиях III фазы и исследованиях биоэквивалентности в роли Координатора.
Кристина Берестян присоединилась к команде X7 Clinical Research в 2019 году в должности Специалист по вводу данных, затем как Специалист по набору субъектов исследования. За время работы в X7 Clinical Research приняла участие в клинических исследованиях III фазы и исследованиях биоэквивалентности в роли Координатора. Ольга Васютичева присоединилась к команде X7 Research в 2020 году в роли Заведующего аптекой. Работала в ООО «Фирма Медмаркет» на должности Фармацевт, ЗАО «Империя — Фарма» на должности Заместитель начальника отдела сертификации фармацевтического склада, в ООО «ПрофСоюз» на должности Заведующий фармацевтическим складом, в ООО «Рабиус» на должности Провизор/Заместитель заведующей аптеки.
Ольга Васютичева присоединилась к команде X7 Research в 2020 году в роли Заведующего аптекой. Работала в ООО «Фирма Медмаркет» на должности Фармацевт, ЗАО «Империя — Фарма» на должности Заместитель начальника отдела сертификации фармацевтического склада, в ООО «ПрофСоюз» на должности Заведующий фармацевтическим складом, в ООО «Рабиус» на должности Провизор/Заместитель заведующей аптеки.
 Вадим Степанов присоединился к команде X7 Clinical Research в 2019 году в должности Врача-терапевта. Участвовал в клинических исследованиях различных нозологий III фазы, биоэквивалентности, в роли Со-исследователя. Работал в ОАО «Системный оператор ЕЭС России» на позиции Врач-терапевт.
Вадим Степанов присоединился к команде X7 Clinical Research в 2019 году в должности Врача-терапевта. Участвовал в клинических исследованиях различных нозологий III фазы, биоэквивалентности, в роли Со-исследователя. Работал в ОАО «Системный оператор ЕЭС России» на позиции Врач-терапевт.